兒科免臨床機會(huì ):利好東亞國家上市產(chǎn)品
“成人用藥數據外推至兒科人群的技術(shù)指導原則”正式稿正視了兒科患者開(kāi)展臨床試驗存在的難度——特有倫理挑戰(如安慰劑的使用)、實(shí)際操作困難(如療效評估、研究中需要為患兒提供特殊保護)、生長(cháng)/發(fā)育顯著(zhù)差異等,并明確了數據外推針對的是有效性和安全性的數據。
通常情況下,數據外推主要針對有效性數據,以獲得明確的劑量。但在一些情況下,充分考慮藥物對不同年齡階段兒科人群的安全性,特別是與生長(cháng)發(fā)育相關(guān)的遠期安全性時(shí),就要關(guān)注安全性數據。
此外,正式明確了適用范圍僅適用于已有中國成人數據的產(chǎn)品外推至中國兒科人群,無(wú)中國成人數據產(chǎn)品的外推不屬于本次指導原則的適用范圍。
數據外推的主要原理也有所調整。按照“征求意見(jiàn)稿”,“兒科人群藥物臨床試驗所使用的數據外推的主要原理是出于倫理學(xué)和效率方面的考慮,避免在目標人群開(kāi)展不必要的研究,從而減少倫理學(xué)擔憂(yōu),并將資源分配到最需要開(kāi)展研究的領(lǐng)域”。在“正式稿”中則為,“通過(guò)科學(xué)的研究方法,將已知中國成人的研究信息和結論,擴展到未知的兒科人群(目標人群)從而減少在未知兒科人群開(kāi)展不必要的研究”。這意味著(zhù)數據外推的原理與倫理學(xué)基本無(wú)關(guān)。
鑒于預測人群間的相似度越高、預測準確度越高時(shí),外推的可能性越大,所需額外研究數據的必要性越低,“正式稿”對數據來(lái)源、評估方法等都有了新的提高:“已知數據”的來(lái)源方面,正式稿增加了“診斷研究、藥代動(dòng)力學(xué)(PK)和藥效動(dòng)力學(xué)(PD)研究”;“相似性”評估增加藥物暴露量和藥物效應關(guān)系的評估;實(shí)施外推分析時(shí)若假設未被驗證,新增“有必要時(shí)再收集數據或可以有數據分段使用的考慮”。
方法學(xué)方面,無(wú)論“正式稿”還是“征求意見(jiàn)稿”,根據外推假設中已知數據在已知人群與目標人群的相似程度,將外推模式分為以下三種:完全外推、部分外推和不進(jìn)行外推。
“完全外推”模式為目標人群與已知人群間具高度相似性,并且假設(預測)具高度準確性?!安糠滞馔啤蹦J綖槟繕巳巳号c已知人群間具一定相似性,和/或假設(預測)具一定不確定性?!安贿M(jìn)行外推”模式為目標人群與已知人群間不具相似性,和/或假設(預測)具有高度不準確性。
“正式稿”根據是否國外已獲批兒科人群適應癥、是否已有國內外兒科人群應用的參考文獻(或其他支持性數據),分為“已有中國成人數據且國外已獲批兒科人群適應癥的數據使用”“有中國成人數據且國內外兒科人群參考文獻可獲得的數據使用”和“僅有中國成人數據的外推”三種情況開(kāi)展外推?!罢髑笠庖?jiàn)稿”則是按數據來(lái)源分為“中國成人數據的外推”“國外兒科人群數據的外推”和“已有文獻或其他支持性數據的外推”。
“正式稿”的“已有中國成人數據且國外已獲批兒科人群適應癥的數據使用”基本和征求意見(jiàn)稿的“國外兒科人群數據的外推”要求基本一致,只是增加了已有中國成人數據這一項。
在已有中國成人數據、國外兒科人群適應癥已獲批的情況下,不同國家或地區的疾病流行病學(xué)、病因、發(fā)病機理和疾病進(jìn)展預后不存在差異;國內外成人患者試驗數據中,不存在顯著(zhù)種族差異,包括臨床藥理學(xué)(藥物代謝動(dòng)力學(xué)、藥效學(xué))和治療學(xué)(醫療實(shí)踐、安全有效性數據)等方面的差異,可沿用國外兒科人群藥物臨床試驗數據。
正式稿的“已有中國成人數據且國內外兒科人群參考文獻可獲得的數據使用”主要對應征求意見(jiàn)稿的“已有文獻或其他支持性數據的外推”一項。正式稿主要提倡的是系統評價(jià)方法。系統評價(jià)分為定量和定性?xún)深?lèi):定量的系統評價(jià)即采用Meta分析方法,定量合并原始研究數據;若納入的研究間存在異質(zhì)性等,不能定量合并,可采用定性描述方式完成。相對于征求意見(jiàn)稿更關(guān)注Meta分析方法,正式稿方法學(xué)更全面。
對于已有中國成人數據,國內外兒科人群適應癥均未獲批、但有國內外兒科人群臨床用藥證據的情況,通過(guò)系統評價(jià)方法后,將現有研究證據作為修訂、完善說(shuō)明書(shū)中兒科人群用藥信息的主要依據,亦即有望可以免臨床。
正式稿的“僅有中國成人數據的外推”對應征求意見(jiàn)稿的“中國成人數據的外推”,基于現有認識,成人臨床試驗數據向兒科人群的外推多數情況下限于療效數據;而兒科人群安全性數據的獲得則通常需要在兒科人群中開(kāi)展試驗,兒科人群安全性臨床試驗是必須做的。
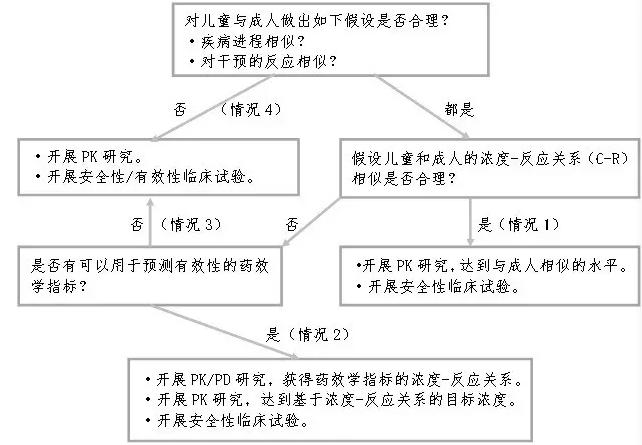
有效性臨床試驗的流程方面,CFDA借鑒了美國食品藥品管理局(FDA)的兒科人群研究設計與外推決策流程圖(見(jiàn)圖1),根據不同的情況相同或類(lèi)似機制藥物在成人及兒科人群間的人體藥代動(dòng)力學(xué)PK、PD試驗結果,從成人劑量外推擬用于兒科人群的劑量。
圖1 兒科人群研究設計與外推決策流程圖
利好方向<<<
綜上所述,“成人用藥數據外推至兒科人群的技術(shù)指導原則”利好國內目前已上市的化學(xué)藥在東亞國家上市時(shí)已增加兒科適應癥的產(chǎn)品,以上產(chǎn)品幾乎無(wú)需再開(kāi)展種族研究,直接可免臨床。
一致性評價(jià)“小改動(dòng)”:為推動(dòng)企業(yè)執行
仿制藥質(zhì)量和療效一致性評價(jià)四大原則中,“研究現場(chǎng)核查指導原則”改為“研制現場(chǎng)核查指導原則”。不過(guò),改動(dòng)并不大,如要求對藥物溶出度儀僅進(jìn)行機械驗證,無(wú)需性能驗證試驗等。
“生產(chǎn)現場(chǎng)檢查指導原則”方面,檢查要點(diǎn)新增申報資料與生物等效性研究和臨床研究中原輔料及內包裝材料的來(lái)源、成品處方與生產(chǎn)工藝、生產(chǎn)批量的一致性。用于生物等效性、臨床研究、體外評價(jià)的藥品的生產(chǎn)過(guò)程,應與生產(chǎn)現場(chǎng)檢查的動(dòng)態(tài)生產(chǎn)過(guò)程以及申報資料內容一致。質(zhì)量風(fēng)險管理的范圍和重點(diǎn),新增了在公司內部進(jìn)行的風(fēng)險管理活動(dòng)。以上內容的調整充分展現了對藥品全生命周期管理的理念。
“生產(chǎn)現場(chǎng)檢查指導原則”刪除了生產(chǎn)批量與申報的批量不一致、生產(chǎn)工藝與申報資料不一致需要進(jìn)一步研究和驗證,表明了工藝和資料在檢查時(shí)就必須要一致的要求,研究和驗證不屬于一致性評價(jià)生產(chǎn)現場(chǎng)檢查的范疇。
“臨床試驗數據核查指導原則”參考了“關(guān)于鼓勵藥品醫療器械創(chuàng )新改革臨床試驗管理的相關(guān)政策”(征求意見(jiàn)稿),“承擔仿制藥一致性評價(jià)臨床試驗項目的醫院資格待總局明確”被刪去。結合“關(guān)于進(jìn)一步規范仿制藥質(zhì)量和療效一致性評價(jià)參比制劑選擇等相關(guān)事宜的指導意見(jiàn)(征求意見(jiàn)稿)”等關(guān)于參比制劑的規定,“參比制劑的合法來(lái)源證明為藥檢報告、藥品說(shuō)明書(shū)等”被刪。
“有因檢查指導原則”則基本沒(méi)有更改。
利好方向<<<
綜上所述,一致性評價(jià)四大指導原則正式稿和征求意見(jiàn)稿之間的改動(dòng)并不大,四大指導原則更多是為了推動(dòng)一致性評價(jià)的進(jìn)程。國內用同一條生產(chǎn)線(xiàn)生產(chǎn)上市并在歐盟、美國或日本獲準上市的藥品和地產(chǎn)化的原研藥品,將有望在指導原則發(fā)布后加快一致性評價(jià)認證過(guò)程。




